
Probiotiques
Définition de l’OMS : « Un probiotique contient des monocultures ou des cultures mixtes vivantes de micro-organismes agissant de façon bénéfique sur l’organisme hôte (animal ou humain) en améliorant les caractéristiques de la microflore qui y réside. »
Ressource canadienne : Dragana Skokovic-Sunjic, pharmacienne. Document de référence pour les études et les produits de chez nous disponible sur le site : https://scienceofprobiotics.ca/.
Pharmacologie
Figure : Régulation de l’homéostasie de l’hôte par les probiotiques 1
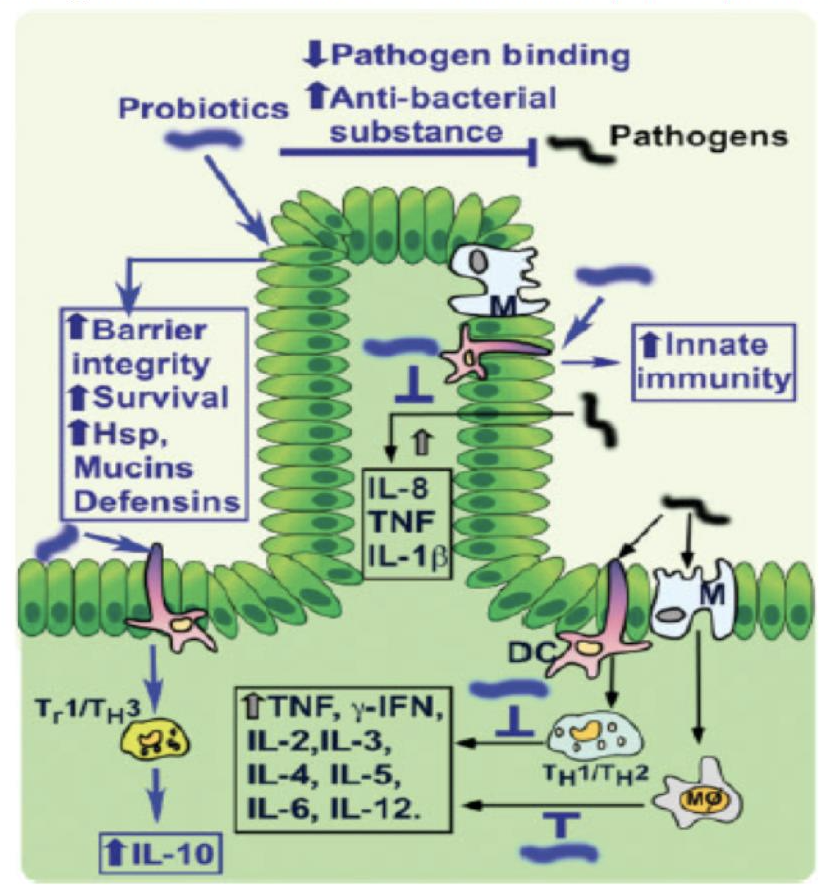
Légende : DC = cellule dendritique; IL = interleukine; M = cellule mucine (productrice de mucus); Hsp = protéine de choc thermique (Heat shock protein)
Les probiotiques induisent plusieurs réponses bénéfiques chez l’hôte qui incluent : 1
- Bloquer les effets pathogènes des bactéries en produisant des substances antibactériennes et en compétitionnant avec les pathogènes pour la liaison aux cellules épithéliales;
- Définir l’équilibre entre une défense immunitaire nécessaire et une défense excessive en augmentant l’immunité naturelle, en améliorant la production de cytokines anti-inflammatoires et en inhibant la production de cytokines pro-inflammatoires;
- Promouvoir l’homéostasie des cellules épithéliales intestinales en augmentant la survie, la fonction barrière et les réponses cytoprotectrices.
Notion de « Quorum Sensing » 2 : Les bactéries communiquent entre elles. Les bactéries pathogènes ne deviennent virulentes que si elles atteignent une certaine concentration, un « quorum ». À partir du moment où elles se sont reconnues et rassemblées en nombre suffisant, leur comportement change et la sécrétion de toxine (ou autre mécanisme pathogène) apparaît. Une des fonctions du microbiote est d’entraver cette communication et d’empêcher le développement de comportements hostiles à l’hôte. On peut facilement faire le parallèle avec les gangs de rue. Chaque membre pris individuellement ne fait pas grand dommage. Par contre, en groupe, les troubles commencent.
Rôle possible comme adjuvant dans l’éradication du H. Pylori.Rosania
Les probiotiques peuvent être considérés comme l’option alternative la plus puissante en développement clinique pour la prévention et le traitement de l'infection chronique. « Probiotics can be regarded as the single most powerful alternative option under clinical development for the prevention and treatment of chronic infection. »Borchert
Protection des voies génito-urinaires par les probiotiques
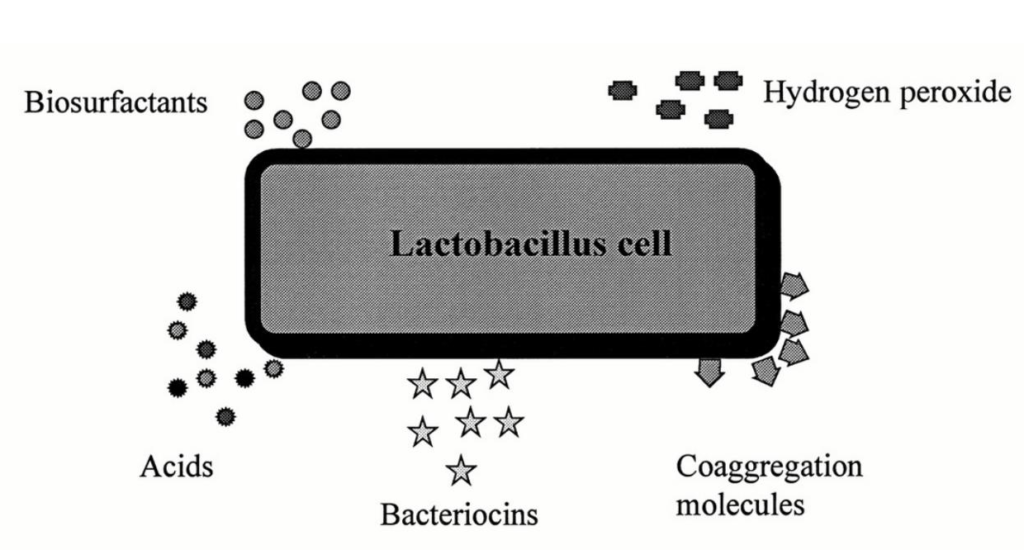
Sous-produits du métabolisme des lactobacilles qui ont un effet antagoniste contre les pathogènes urinaires et vaginaux. Les biosurfactants inhibent l'adhésion; les acides, les bactériocines et le peroxyde d'hydrogène inhibent la croissance; et les molécules de coagrégation bloquent la propagation des agents pathogènes. Source : Reid G. Am J Clin Nutr. 2001.Reid 2001
- Prometteurs pour améliorer la santé urogénitale. Waigankar
- L’usage oral de lactobacilles semble fournir une certaine protection. Reid2003
- Un produit complexe (Lactobacillus acidophillus, Lactobacillus rhamnosum, Bifidobacterium longum, Bifidobacterium bifidum, Saccharomyces boulardi, Saccharomyces thermophilus, fructo-oligosaccharides) aide à réduire la prolifération de Candida chez des enfants aux soins intensifs. Kumar
- Études sur des souches uniques :
- L. crispatus, intravaginal (5 X 108 CFU par ovule vaginal; 1 ovule par jour durant 5 jours et 1 ovule par semaine durant 10 semaines) : réduction d’environ 50% de la fréquence des infections urinaires récurrentes; 15% d’infection vérifiée par culture vs 27% dans le groupe placébo (RR, 0,5; IC 95% 0,2-1,2). Stapleton
- Ovules vaginaux de L. crispatus : effets secondaires similaires au placébo Czaja; effet significatif sur les récurrences (p=0,0007). Uehara
- Étude russe sur Bacillus subtilis : accélération de l’élimination du pathogène. Pushkarev
- L. rhamnosus GG ne semble pas être utile.Colodner, Reid FEMS 2001
Indications
Diarrhées associées aux antibiotiques (DAA) (prévention et traitement)
Diarrhées à rotavirus et infectieuses (prévention et traitement)
C. difficile (prévention et adjuvant)
Turista (prévention et traitement)
Vaginite / vaginose (prévention et traitement, mais principalement adjuvant)
Syndrome de l’intestin irritable (SII) / coliques (prévention et réduction des symptômes)
Maladies inflammatoires intestinales (MII) (adjuvant)
Hygiène buccale (gingivite, plaque, etc.) : usage local – gomme, pastille, etc.
Constipation, en particulier dans la maladie de Parkinson.18
2 indications en émergence :
- Axe intestin – cerveau, relié à la tolérance au stress (triangle microbiote – intestin / système immunitaire – système nerveux central).17,19-21
- Impact sur l’inflammation systémique 1 et le système immunitaire 22,23 : prévention des infections et réduction de l’inflammation sourde / intestin perméable.24,25
Dosages
La dose minimale efficace, en traitement de la diarrhée, semble être de 10 milliards.26 Sauf exception, 10 milliards et plus, jusqu’à 100 milliards peuvent être utilisé en toute sécurité.
Pour le syndrome de l’intestin irritable (SII) : 1 et 50 milliards Ritchie, plus probablement entre 10 et 50 milliards. Privilégier les produits multisouches.
La capacité de pénétrer dans l’intestin, donc de passer l’estomac et le duodénum (bile) varie d’une souche et d’une famille à l’autre. Ainsi, les bifidobactéries (BB536) passent plus facilement ces barrières. Les bifidobactéries peuvent donc être aussi efficaces, à dose plus faible, que les lactobacilles. Par contre, les lactobacilles peuvent survivre dans l’estomac et sont donc plus intéressants pour les troubles de l’estomac, gastrite, H. Pylori.
Intestin perméable : Les études cliniques sont rares et les souches non identifiées. Plusieurs souches différentes agissent à différents endroits dans l’intestin. Mieux vaut travailler avec des produits multisouches.
Infection urinaire prévention et/ou adjuvant. Head
- Préférer les formules complexes, riches en lactobacilles.
- Pour un meilleur effet, combiner les formes orale et vaginale : prise orale à long terme (6 mois, voire plusieurs années); forme vaginale durant environ 10 semaines (1 ovule au coucher durant 5 à 7 jours, puis 1 ovule par semaine durant environ 10 semaines).
- Dose orale : minimum 1 milliard CFU; 6 à 10 milliards est préférable pour coloniser la flore vaginale / pelvienne.Reid FEMS 2001
Effets secondaires
Ballonnements transitoires. Le cas échant, cessez ou diminuez la dose durant environ une semaine.
Interactions
Pas de d’interaction connue, ni de résistance transmissible.
Grossesse et allaitement
Sécuritaire
Contre-indication
Aucune connue. Théoriquement, les maladies intestinales inflammatoires en phase aigüe avec ulcération seraient une contrindication selon certains. Mais la preuve de dommage n’est pas là.
Notes
On entend souvent dire que le risque d’infection est augmenté par la prise de probiotiques. C’est faux.27 Les bactériémies à lactobacilles existent avec ou sans prise de probiotiques. Par contre, le risque de translocation de la levure S. Boulardii est possible et documenté. Notez cependant que les probiotiques sont pour les patients ambulatoires, pas pour ceux aux soins intensifs, sauf exception.
Les bactéries probiotiques sont extrêmement sensibles aux antibiotiques.28
On ne se fie pas au nombre mais à la qualité des probiotiques, pas besoin d’une dose cheval si les bactéries passent dans l’estomac! 1,3 milliards est suffisant. 54
Références
1. Vanderpool C, Yan F, Polk DB. Mechanisms of probiotic action: Implications for therapeutic applications in inflammatory bowel diseases. Inflamm Bowel Dis. 2008 Nov;14(11):1585-96. Review. PubMed PMID: 18623173. (Texte complet accessible gratuit) https://www.ncbi.nlm.nih.gov/pubmed/18623173
2. Bonnie Bassler : https://www.ted.com/talks/bonnie_bassler_on_how_bacteria_communicate.html
3. Eslamparast T, Zamani F, Hekmatdoost A, Sharafkhah M, Eghtesad S, Malekzadeh R, Poustchi H. Effects of synbiotic supplementation on insulin resistance in subjects with the metabolic syndrome: a randomised, double-blind, placebo-controlled pilot study. Br J Nutr. 2014 Aug;112(3):438-45. doi: 10.1017/S0007114514000919. PubMed PMID: 24848793. https://www.ncbi.nlm.nih.gov/pubmed/24848793
4. Xiao S, Zhao L. Gut microbiota-based translational biomarkers to prevent metabolic syndrome via nutritional modulation. FEMS Microbiol Ecol. 2014 Feb;87(2):303-14. doi: 10.1111/1574-6941.12250. Review. PubMed PMID: 24219358; PubMed Central PMCID: PMC4262049. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4262049/
5. Forchielli ML, Walker WA. The role of gut-associated lymphoid tissues and mucosal defence. Br J Nutr. 2005 Apr;93 Suppl 1:S41-8. Review. PubMed PMID: 15877894. https://www.ncbi.nlm.nih.gov/pubmed/15877894
6. Cross ML. Immune-signalling by orally-delivered probiotic bacteria: effects on common mucosal immunoresponses and protection at distal mucosal sites. Int J Immunopathol Pharmacol. 2004 May-Aug;17(2):127-34. Review. PubMed PMID: 15171813. https://www.ncbi.nlm.nih.gov/pubmed/15171813
7. de Vrese M, Winkler P, Rautenberg P, Harder T, Noah C, Laue C, Ott S, Hampe J, Schreiber S, Heller K, Schrezenmeir J. Probiotic bacteria reincidence of common cold episodes in a double blind, randomized, controlled trial. Vaccine. 2006 Nov 10;24(44-46):6670-4. PubMed PMID: 16844267. https://www.ncbi.nlm.nih.gov/pubmed/16844267
8. Leyer GJ, Li S, Mubasher ME, Reifer C, Ouwehand AC. Probiotic effects on cold and influenza-like symptom incidence and duration in children. Pediatrics. 2009 Aug;124(2):e172-9. doi: 10.1542/peds.2008-2666. Epub 2009 Jul 27. PubMed PMID: 19651563. https://www.ncbi.nlm.nih.gov/pubmed/19651563
9. Arimori Y, Nakamura R, Hirose Y, Murosaki S, Yamamoto Y, Shidara O, Ichikawa H, Yoshikai Y. Daily intake of heat-killed Lactobacillus plantarum L-137 enhances type I interferon production in healthy humans and pigs. Immunopharmacol Immunotoxicol. 2012 Dec;34(6):937-43. doi: 10.3109/08923973.2012.672425. Epub 2012 Apr 2. PubMed PMID: 22468623. https://www.ncbi.nlm.nih.gov/pubmed/22468623
10. Nagai T, Makino S, Ikegami S, Itoh H, Yamada H. Effects of oral administration of yogurt fermented with Lactobacillus delbrueckii ssp. bulgaricus OLL1073R-1 and its exopolysaccharides against influenza virus infection in mice. Int Immunopharmacol. 2011 Dec;11(12):2246-50. doi: 10.1016/j.intimp.2011.09.012. Epub 2011 Oct 8. PubMed PMID: 21986509. https://www.ncbi.nlm.nih.gov/pubmed/21986509
11. Ukena SN, Singh A, Dringenberg U, Engelhardt R, Seidler U, Hansen W, Bleich A, Bruder D, Franzke A, Rogler G, Suerbaum S, Buer J, Gunzer F, Westendorf AM. Probiotic Escherichia coli Nissle 1917 inhibits leaky gut by enhancing mucosal integrity. PLoS One. 2007 Dec 12;2(12):e1308. PubMed PMID: 18074031; PubMed Central PMCID: PMC2110898. https://dx.plos.org/10.1371/journal.pone.0001308
12. Ewaschuk JB, Diaz H, Meddings L, Diederichs B, Dmytrash A, Backer J, Looijer-van Langen M, Madsen KL. Secreted bioactive factors from Bifidobacterium infantis enhance epithelial cell barrier function. Am J Physiol Gastrointest Liver Physiol. 2008 Nov;295(5):G1025-34. doi: 10.1152/ajpgi.90227.2008. PubMed PMID: 18787064. https://ajpgi.physiology.org/content/295/5/G1025
13. Lutgendorff F, Akkermans LM, Söderholm JD. The role of microbiota and probiotics in stress-induced gastro-intestinal damage. Curr Mol Med. 2008 Jun;8(4):282-98. Review. PubMed PMID: 18537636. https://www.ncbi.nlm.nih.gov/pubmed/18537636
14. Lamprecht M, Bogner S, Schippinger G, Steinbauer K, Fankhauser F, Hallstroem S, Schuetz B, Greilberger JF. Probiotic supplementation affects markers of intestinal barrier, oxidation, and inflammation in trained men; a randomized, double-blinded, placebo-controlled trial. J Int Soc Sports Nutr. 2012 Sep 20;9(1):45. doi: 10.1186/1550-2783-9-45. PubMed PMID: 22992437; PubMed Central PMCID: PMC3465223. https://www.jissn.com/content/9/1/45
15. Shing CM, Peake JM, Lim CL, Briskey D, Walsh NP, Fortes MB, Ahuja KD, Vitetta L. Effects of probiotics supplementation on gastrointestinal permeability, inflammation and exercise performance in the heat. Eur J Appl Physiol. 2014 Jan;114(1):93-103. doi: 10.1007/s00421-013-2748-y. PubMed PMID: 24150782. https://www.ncbi.nlm.nih.gov/pubmed/24150782
16. Rosenfeldt V, Benfeldt E, Valerius NH, Paerregaard A, Michaelsen KF. Effect of probiotics on gastrointestinal symptoms and small intestinal permeability in children with atopic dermatitis. J Pediatr. 2004 Nov;145(5):612-6. PubMed PMID: 15520759. https://www.ncbi.nlm.nih.gov/pubmed/15520759
17. Erdman SE, Poutahidis T. Probiotic 'glow of health': it's more than skin deep. Benef Microbes. 2014 Jun 1;5(2):109-19. doi: 10.3920/BM2013.0042. Review. PubMed PMID: 24675231; PubMed Central PMCID: PMC4354898. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4354898/
18. Cassani E, Privitera G, Pezzoli G, Pusani C, Madio C, Iorio L, Barichella M. Use of probiotics for the treatment of constipation in Parkinson's disease patients. Minerva Gastroenterol Dietol. 2011 Jun;57(2):117-21. PubMed PMID: 21587143. https://www.ncbi.nlm.nih.gov/pubmed/21587143
19. Hyland NP, Quigley EM, Brint E. Microbiota-host interactions in irritable bowel syndrome: epithelial barrier, immune regulation and brain-gut interactions. World J Gastroenterol. 2014 Jul 21;20(27):8859-66. doi: 10.3748/wjg.v20.i27.8859. PubMed PMID: 25083059; PubMed Central PMCID: PMC4112904. https://www.wjgnet.com/1007-9327/full/v20/i27/8859.htm
20. Bowe W, Patel NB, Logan AC. Acne vulgaris, probiotics and the gut-brain-skin axis: from anecdote to translational medicine. Benef Microbes. 2014 Jun 1;5(2):185-99. doi: 10.3920/BM2012.0060. PubMed PMID: 23886975. https://wageningenacademic.metapress.com/content/0u3x16807123w358/?genre=article&id=doi%3a10.3920%2fBM2012.0060#.VBXBXCh2liA
21. Konturek PC, Brzozowski T, Konturek SJ. Stress and the gut: pathophysiology, clinical consequences, diagnostic approach and treatment options. J Physiol Pharmacol. 2011 Dec;62(6):591-9. Review. PubMed PMID: 22314561. https://www.jpp.krakow.pl/journal/archive/12_11/pdf/591_12_11_article.pdf
22. Candela M, Turroni S, Biagi E, Carbonero F, Rampelli S, Fiorentini C, Brigidi P. Inflammation and colorectal cancer, when microbiota-host mutualism breaks. World J Gastroenterol. 2014 Jan 28;20(4):908-22. doi: 10.3748/wjg.v20.i4.908. Review. PubMed PMID: 24574765; PubMed Central PMCID: PMC3921544. https://www.wjgnet.com/1007-9327/full/v20/i4/908.htm
23. Vieira AT, Teixeira MM, Martins FS. The role of probiotics and prebiotics in inducing gut immunity. Front Immunol. 2013 Dec 12;4:445. doi: 10.3389/fimmu.2013.00445. Review. PubMed PMID: 24376446; PubMed Central PMCID: PMC3859913. https://dx.doi.org/10.3389/fimmu.2013.00445
24. Barbara G, Zecchi L, Barbaro R, Cremon C, Bellacosa L, Marcellini M, De Giorgio R, Corinaldesi R, Stanghellini V. Mucosal permeability and immune activation as potential therapeutic targets of probiotics in irritable bowel syndrome. J Clin Gastroenterol. 2012 Oct;46 Suppl:S52-5. doi: 10.1097/MCG.0b013e318264e918. PubMed PMID: 22955358. https://www.ncbi.nlm.nih.gov/pubmed/22955358
25. Ukena SN, Singh A, Dringenberg U, Engelhardt R, Seidler U, Hansen W, Bleich A, Bruder D, Franzke A, Rogler G, Suerbaum S, Buer J, Gunzer F, Westendorf AM. Probiotic Escherichia coli Nissle 1917 inhibits leaky gut by enhancing mucosal integrity. PLoS One. 2007 Dec 12;2(12):e1308. PubMed PMID: 18074031; PubMed Central PMCID: PMC2110898. https://dx.plos.org/10.1371/journal.pone.0001308
26. Johnston BC, Ma SS, Goldenberg JZ, Thorlund K, Vandvik PO, Loeb M, Guyatt GH. Probiotics for the prevention of Clostridium difficile-associated diarrhea: a systematic review and meta-analysis. Ann Intern Med. 2012 Dec 18;157(12):878-88. Review. PubMed PMID: 23362517.
27. Salminen MK, Tynkkynen S, Rautelin H, Saxelin M, Vaara M, Ruutu P, Sarna S, Valtonen V, Järvinen A. Lactobacillus bacteremia during a rapid increase in probiotic use of Lactobacillus rhamnosus GG in Finland. Clin Infect Dis. 2002 Nov 15;35(10):1155-60. PubMed PMID: 12410474.
28. D'Aimmo MR, Modesto M, Biavati B. Antibiotic resistance of lactic acid bacteria and Bifidobacterium spp. isolated from dairy and pharmaceutical products. Int J Food Microbiol. 2007 Apr 1;115(1):35-42. PubMed PMID: 17198739.
29. Zoghi A, Khosravi-Darani K, Sohrabvandi S. Surface binding of toxins and heavy metals by probiotics. Mini Rev Med Chem. 2014 Jan;14(1):84-98. Review. PubMed PMID: 24329992. https://www.eurekaselect.com/118830/article
30. Monachese M, Burton JP, Reid G. Bioremediation and tolerance of humans to heavy metals through microbial processes: a potential role for probiotics? Appl Environ Microbiol. 2012 Sep;78(18):6397-404. doi: 10.1128/AEM.01665-12. PubMed PMID: 22798364; PubMed Central PMCID: PMC3426676. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3426676/
31. Halttunen T, Collado MC, El-Nezami H, Meriluoto J, Salminen S. Combining strains of lactic acid bacteria may reduce their toxin and heavy metal removal efficiency from aqueous solution. Lett Appl Microbiol. 2008 Feb;46(2):160-5. PubMed PMID: 18028332. https://www.ncbi.nlm.nih.gov/pubmed/18028332
32. Zhai Q, Narbad A, Chen W. Dietary strategies for the treatment of cadmium and lead toxicity. Nutrients. 2015 Jan 14;7(1):552-71. doi: 10.3390/nu7010552. PubMed PMID: 25594439; PubMed Central PMCID: PMC4303853. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4303853/
33. Zhai Q, Wang G, Zhao J, Liu X, Tian F, Zhang H, Chen W. Protective effects of Lactobacillus plantarum CCFM8610 against acute cadmium toxicity in mice. Appl Environ Microbiol. 2013 Mar;79(5):1508-15. doi: 10.1128/AEM.03417-12. PubMed PMID: 23263961; PubMed Central PMCID: PMC3591948. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3591948/
34. Tian F, Zhai Q, Zhao J, Liu X, Wang G, Zhang H, Zhang H, Chen W. Lactobacillus plantarum CCFM8661 alleviates lead toxicity in mice. Biol Trace Elem Res. 2012 Dec;150(1-3):264-71. doi: 10.1007/s12011-012-9462-1. PubMed PMID: 22684513. https://www.ncbi.nlm.nih.gov/pubmed/22684513
35. Rosania R, Minenna MF, Giorgio F, Facciorusso A, De Francesco V, Hassan C, Panella C, Ierardi E. Probiotic multistrain treatment may eradicate Helicobacter pylori from the stomach of dyspeptics: a placebo-controlled pilot study. Inflamm Allergy Drug Targets. 2012 Jun;11(3):244-9. PubMed PMID: 22452604. https://www.ncbi.nlm.nih.gov/pubmed/22452604
36. Didari T, Mozaffari S, Nikfar S, Abdollahi M. Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World J Gastroenterol. 2015 Mar 14;21(10):3072-84. doi: 10.3748/wjg.v21.i10.3072. PubMed PMID: 25780308; PubMed Central PMCID: PMC4356930. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4356930/
37. Ritchie ML, Romanuk TN. A meta-analysis of probiotic efficacy for gastrointestinal diseases. PLoS One. 2012;7(4):e34938. doi: 10.1371/journal.pone.0034938. PubMed PMID: 22529959; PubMed Central PMCID: PMC3329544. https://dx.plos.org/10.1371/journal.pone.0034938
38. Hungin AP, Mulligan C, Pot B, Whorwell P, Agréus L, Fracasso P, Lionis C, Mendive J, Philippart de Foy JM, Rubin G, Winchester C, de Wit N; European Society for Primary Care Gastroenterology. Systematic review: probiotics in the management of lower gastrointestinal symptoms in clinical practice -- an evidence-based international guide. Aliment Pharmacol Ther. 2013 Oct;38(8):864-86. doi: 10.1111/apt.12460. Review. PubMed PMID: 23981066; PubMed Central PMCID: PMC3925990. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3925990/
39. Kajander K, Krogius-Kurikka L, Rinttilä T, Karjalainen H, Palva A, Korpela R. Effects of multispecies probiotic supplementation on intestinal microbiota in irritable bowel syndrome. Aliment Pharmacol Ther. 2007 Aug 1;26(3):463-73. PubMed PMID: 17635381. https://onlinelibrary.wiley.com/doi/10.1111/j.1365-2036.2007.03391.x/abstract;jsessionid=46163995EE3DE49E9421E3A73832A5C1.f04t04
40. Whelan K, Quigley EM. Probiotics in the management of irritable bowel syndrome and inflammatory bowel disease. Curr Opin Gastroenterol. 2013 Mar;29(2):184-9. doi: 10.1097/MOG.0b013e32835d7bba. Review. PubMed PMID: 23286925. https://www.ncbi.nlm.nih.gov/pubmed/23286925
41. Saez-Lara MJ, Gomez-Llorente C, Plaza-Diaz J, Gil A. The role of probiotic lactic acid bacteria and bifidobacteria in the prevention and treatment of inflammatory bowel disease and other related diseases: a systematic review of randomized human clinical trials. Biomed Res Int. 2015;2015:505878. doi: 10.1155/2015/505878. Review. PubMed PMID: 25793197; PubMed Central PMCID: PMC4352483. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4352483/
42. Borchert D, Sheridan L, Papatsoris A, Faruquz Z, Barua JM, Junaid I, Pati Y, Chinegwundoh F, Buchholz N. Prevention and treatment of urinary tract infection with probiotics: Review and research perspective. Indian J Urol. 2008 Apr;24(2):139-44. PubMed PMID: 19468386; PubMed Central PMCID: PMC2684288. https://www.indianjurol.com/text.asp?2008/24/2/139/40604
43. Reid G. Probiotic agents to protect the urogenital tract against infection. Am J Clin Nutr. 2001 Feb;73(2 Suppl):437S-443S. Review. PubMed PMID: 11157354. https://ajcn.nutrition.org/content/73/2/437s.long
44. Waigankar SS, Patel V. Role of probiotics in urogenital healthcare. J Midlife Health. 2011 Jan;2(1):5-10. doi: 10.4103/0976-7800.83253. PubMed PMID: 21897732; PubMed Central PMCID: PMC3156505. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3156505/
45. Reid G, Charbonneau D, Erb J, Kochanowski B, Beuerman D, Poehner R, Bruce AW. Oral use of Lactobacillus rhamnosus GR-1 and L. fermentum RC-14 significantly alters vaginal flora: randomized, placebo-controlled trial in 64 healthy women. FEMS Immunol Med Microbiol. 2003 Mar 20;35(2):131-4. PubMed PMID: 12628548. https://femsim.oxfordjournals.org/content/35/2/131.long
46. Kumar S, Bansal A, Chakrabarti A, Singhi S. Evaluation of efficacy of probiotics in prevention of candida colonization in a PICU-a randomized controlled trial. Crit Care Med. 2013 Feb;41(2):565-72. doi: 10.1097/CCM.0b013e31826a409c. PubMed PMID: 23361033. https://www.ncbi.nlm.nih.gov/pubmed/23361033
47. Stapleton AE, Au-Yeung M, Hooton TM, Fredricks DN, Roberts PL, Czaja CA, Yarova-Yarovaya Y, Fiedler T, Cox M, Stamm WE. Randomized, placebo-controlled phase 2 trial of a Lactobacillus crispatus probiotic given intravaginally for prevention of recurrent urinary tract infection. Clin Infect Dis. 2011 May;52(10):1212-7. doi: 10.1093/cid/cir183. PubMed PMID: 21498386; PubMed Central PMCID: PMC3079401. https://cid.oxfordjournals.org/content/52/10/1212.long
48. Czaja CA, Stapleton AE, Yarova-Yarovaya Y, Stamm WE. Phase I trial of a Lactobacillus crispatus vaginal suppository for prevention of recurrent urinary tract infection in women. Infect Dis Obstet Gynecol. 2007;2007:35387. doi: 10.1155/2007/35387. PubMed PMID: 18288237; PubMed Central PMCID: PMC2216064. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2216064/
49. Uehara S, Monden K, Nomoto K, Seno Y, Kariyama R, Kumon H. A pilot study evaluating the safety and effectiveness of Lactobacillus vaginal suppositories in patients with recurrent urinary tract infection. Int J Antimicrob Agents. 2006 Aug;28 Suppl 1:S30-4. PubMed PMID: 16859900. https://www.ncbi.nlm.nih.gov/pubmed/16859900
50. Pushkarev AM, Tuĭgunova VG, Zaĭnullin RR, Kuznetsova TN, Gabidullin IuZ. [Use of antagonistic Bacillus subtilis bacteria for treatment of nosocomial urinary tract infections]. Zh Mikrobiol Epidemiol Immunobiol. 2007 Mar-Apr;(2):90-3. Russian. PubMed PMID: 17523489. https://www.ncbi.nlm.nih.gov/pubmed/17523489
51. Colodner R, Edelstein H, Chazan B, Raz R. Vaginal colonization by orally administered Lactobacillus rhamnosus GG. Isr Med Assoc J. 2003 Nov;5(11):767-9. PubMed PMID: 14650098. https://www.ima.org.il/IMAJ/ViewArticle.aspx?year=2003&month=11&page=767
52. Reid G, Beuerman D, Heinemann C, Bruce AW. Probiotic Lactobacillus dose required to restore and maintain a normal vaginal flora. FEMS Immunol Med Microbiol. 2001 Dec;32(1):37-41. PubMed PMID: 11750220. https://femsim.oxfordjournals.org/content/32/1/37.long
53. Head KA. Natural approaches to prevention and treatment of infections of the lower urinary tract. Altern Med Rev. 2008 Sep;13(3):227-44. Review. PubMed PMID: 18950249. https://www.altmedrev.com/publications/13/3/227.pdf
54. Mimi Demers, Anne Dagnault, Josée Desjardins, Department of Radio-Oncology, University Health Center, Hôtel Dieu de Québec, Québec, Canada, A randomized double-blind controlled trial: Impact of probiotics on diarrhea in patients treated with pelvic radiationArticle history: Volume 33, Issue 5, October 2014, Pages 761-767 https://www.sciencedirect.com/science/article/abs/pii/S0261561413002744
55. Sun et al., 2019. Beneficial effect of probiotics supplements in reflux esophagitis treated with esomeprazole: A randomized controlled trial, World J Gastroenterol 2019 7; 25(17): 2110-2121.
56. • Shi et al., 2020. Effect of Combined Live Probiotics Alleviating the Gastrointestinal Symptoms of Functional Bowel Disorders, Gastroenterology Research and Practice Volume 2020, Article ID 4181748, 11 pages.



